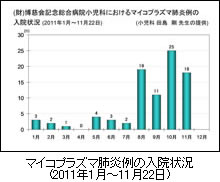
本年(2011年)初夏から,学童を中心に Mycoplasma pneumoniae (マイコプラズマ)による感染症が流行しています。しかも,今流行しているマイコプラズマは,優れた感受性を有し治療の第一選択薬であった抗生物質のマクロライド系薬 (MLs) に高度耐性化しています。このため,MLs を投与しても臨床症状がなかなか改善せず,遷延化する例あるいは入院する例も増えてきています 1,2)。本症は強い咳嗽を主訴とするため,学童間に容易に広がりやすいことも流行を助長する一因となっているように思われます。(財)博慈会記念総合病院小児科におけるマイコプラズマ肺炎例の入院状況 (2011年1月~11月22日)
このようなマイコプラズマにどのような抗菌薬が適正であるかということを調べるには,培養検査を行い,菌そのものを分離して抗菌薬に対する感受性を調べる必要があります。しかし,培養には特殊な培地が必要であるのみならず,菌が発育してくるまでには1週間以上の時間がかかり臨床での治療には間に合わないことから,培養はほとんど行われていないのが実情です。
私どもの研究室は約10年前よりマイコプラズマに限らず,小児の市中肺炎 (community-acquired pneumonia: CAP) に関係する肺炎球菌やインフルエンザ菌が抗菌薬に急速に耐性化してきている現状に鑑み,小児の CAP の誘因ともなる種々のウイルスをも含めて,これらの病原微生物を網羅的に検索できる real-time PCR 法を確立しました 3,4)。そして,このようなことに関心をお持ちの小児科の先生方との共同研究として,小児の CAP に関与する病原微生物の検索と,検出された微生物の抗菌薬に対する耐性菌の出現状況,およびその耐性機構について研究を行ってきました。
小児における本年のマイコプラズマ感染症の流行に対し,多くの方々に関心を持っていただきたいと考え,共同で研究している小児科の先生方とも相談し,「附:マイコプラズマ」として本邦における MLs 耐性マイコプラズマの現状について,今までに調べてきた研究結果を公開することにいたしました。
1. MLs 耐性マイコプラズマの出現とその年次的変化
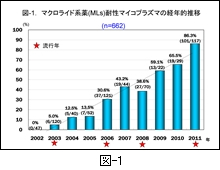
マイコプラズマ感染症の症例から MLs 耐性マイコプラズマを分離し,世界で最初に報告されたのは神奈川県衛生研究所の岡崎ら 5)です。私どもの研究室で MLs 耐性マイコプラズマを分離し始めたのは2003年からで,その年は6株(5.0%)が分離されています 6,7)。
図-1 には,私どもの研究室における2002年から本年10月までの間における MLs 耐性マイコプラズマの経年的推移を示します。MLs 耐性マイコプラズマの分離率が年次的に急速に上昇してきています。
特に,本年はマイコプラズマの流行年にあたり,80%以上のマイコプラズマが MLs 耐性となっています。
2. マイコプラズマとはどのような菌か?
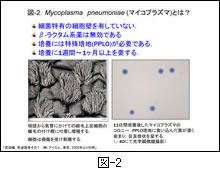
マイコプラズマは一般の細菌(大腸菌やブドウ球菌など)とは異なり,細菌の特徴である細胞壁を持たず,細胞質膜のみで形態を保っている特殊な菌です。
そして,図-2 に示すように,培地上に発育することができる最小の細菌として知られています。その培養には PPLO 培地という特殊な培地が必要で,しかも培養には1週間から1ヶ月程度を必要とします。
また,細胞壁を持たないため,細胞壁を作用標的とするβ-ラクタム系薬は全く無効とされています。既存の抗菌薬の中で最も感受性が優れ,臨床的にも有効とされてきたのが MLs でした。
3. マイコプラズマ感染の成立と症状の特徴
マイコプラズマ感染は,菌がヒトの上気道へ侵入することから始まります。侵入した菌は,菌体のとがった先端部の細胞吸着器官 (PIタンパク群) で気道表面の線毛上皮細胞の線毛付け根部分に接着して増殖し,細胞に直接的な損傷を与えることにより感染が成立します(直接障害)。この PI タンパクをコードする遺伝子配列には2タイプあることが知られ,I 型と II 型が交互に流行を繰り返すといわれています 8)。
感染が成立し遷延化してきますと,マクロファージを介した各種炎症性サイトカイン(IL-8, IL-18等)の産生が誘導され,間接的な炎症反応が強くなります(間接障害)。マイコプラズマは全ゲノム解析が行なわれており 9,10),感染成立の機序については遺伝子レベルで明らかにされてきています 11)。
マイコプラズマ感染症は急性気管支炎や肺炎が主ですが,その他に咽頭炎や急性中耳炎,まれに髄膜炎の原因となることもあり多彩です。臨床症状としては38℃台の高熱が5日間ほど続くことと,咳嗽もまた長く続くことが特徴とされてきました。菌が増えるのに時間がかかるため,マイコプラズマが侵入してから発症までの潜伏期間は1~4週(主に2~3週)といわれています。
また,マイコプラズマ肺炎はその肺炎像から異型肺炎と呼ばれていましたが,近年 PCR 等の迅速診断技術の進歩により,起炎微生物を網羅的に検索すれば,速やかに確定診断が可能ですので,マイコプラズマ肺炎やクラミジア肺炎などのように,病原体の名称を付けて呼ばれることが多くなっています。
4. 小児の CAP におけるマイコプラズマの関わり
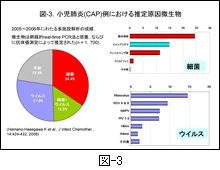
図-3 は,私どもの研究室と10医療施設の小児科の先生方との共同研究によって,前述したウイルスと細菌とを網羅的に検索できる real-time PCR 法で調べた小児 CAP (n=1,700) の原因微生物の成績です。なお,抗体価が調べられる病原微生物については,ペアー血清による抗体価の上昇の有無も調べられています。また,細菌陽性例については,胸部X線像はもとより,発症当初の末梢白血球数と核左方移動の有無の他に,CRP や血沈についても調べ,さらにその後の臨床経過についても調べて,細菌感染の有無を推定しています。
結果をみますと,ウイルスあるいは細菌と推定された例がほぼ半数ずつとなっています。その内訳を 図-3の右側 に示しましたが,細菌では肺炎球菌の割合が高く,次いでマイコプラズマであり,インフルエンザ菌の関与は3番目となっています。ウイルスでは抗体の有意上昇が測定できないRhinovirus の陽性率が最も高いのですが,それを除くと RSV (respiratory syncytial virus subgroup A & B) の関与が高く,次いで hMPV (human metapneumovirus), PIV (parainfluenzavirus 1-3) の順となっています。つまり,パラミクソウイルス科に属して肺細胞に対する親和性が高いとされるウイルスの陽性率が高いことが示されています。
5. マイコプラズマ感染症の好発年齢
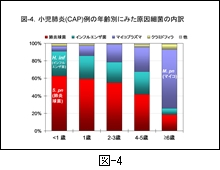
マイコプラズマ感染症は学童期の代表的な感染症といわれています。図-4 に前述した小児の CAP 例における年齢別の推定原因細菌の内訳を示しました。1歳以下では肺炎球菌とインフルエンザ菌の関与する割合が高く,マイコプラズマによる肺炎は滅多にみられていません。2歳以上になりますと次第にマイコプラズマによる CAP が増えてくることが示され,6歳以上(学童期)ではマイコプラズマ肺炎の占める割合が極めて高くなっているところに特徴があります。
なお,マイコプラズマ感染症には自然治癒例があることもよく知られていることで,また CAP を発症したとしても,一般には軽症から中等症であることが多いとされていますが,中には重症化する例があることも事実です。
『私どもの小児マイコプラズマ肺炎例における検査値データの集計によりますと,年齢によって多少の相違はありますが,一般的には, i) WBCは正常値よりやや高い程度で平均値は6,600 cells/μl (2.300-19.800)であること, ii) 好中球優位であること, iii) CRP の平均値は 1.8 mg/dL (0.1-13.4)程度であること, iv) 血沈が亢進している場合が多いことなどが明らかにされています。』
6. マイコプラズマ感染症の診断 12)
マイコプラズマ感染症の診断には次の4つの方法があります。
ひとつは,今でも主として行なわれている免疫血清学的診断です。寒冷凝集反応 (CHA),酵素免疫測定法 (ELISA法),微粒子凝集反応 (PA法,HDPA法),補体結合反応 (CF) があります。通常,急性期と2-3週後の回復期のペアー血清で診断が行なわれます。PA 法は特異的 IgM 抗体を測定するので診断上優れていますが,入院時の単一血清のみでは診断できない場合が往々にして認められることが難点です。
2つ目はマイコプラズマを分離する培養法です。確実ではありますが,先に述べたようにPPLO培地を用いなければならず,また培養に日数を要することが難点です。
3つめは,保険適用となっているキットのイムノカード「マイコプラズマ抗体キット」です。IgM を検出する本キットは迅速性に優れていますが,特異抗体の上昇には数日かかることや,乳幼児や成人でもまれに特異抗体が上昇しない例があることです。また,偽陽性がみられる場合もあります。
4つ目は,DNAレベルで迅速にマイコプラズマの有無を検索する方法です。i) 電気泳動を伴ういわゆる従来のPCR法,ii) LAMP 法 13),iii) 蛍光標識したプローブを用いる real-time PCR 法 3)です。LAMP 法は日本で開発された方法で,最近保険適用となりました。
しかし,感染症の診断に PCR 法を応用するからには,細菌からウイルスまで網羅的に(マルチに)検索しようというのが世界的な潮流で,FDA によって既に承認されたものもあります。
7. real-time PCR 法を併用した効率的なマイコプラズマの分離
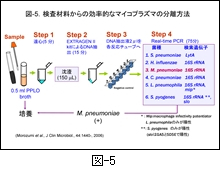
図-5 には,私どもが確立した real-time PCR 法による細菌の網羅的検索法のプロトコールを示します。検査材料(上咽頭ぬぐい液)から DNA を抽出し,その DNA 液を用いてマイコプラズマを含む6菌種を同時に検索しています。ここには示しませんがウイルスも同様に検索しています。
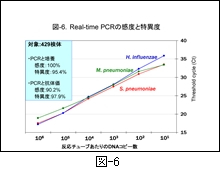
その感度を小児 CAP の主たる原因細菌である肺炎球菌とマイコプラズマおよびインフルエンザ菌について 図-6 に示しました。3菌種とも PCR と培養との間には,感度100%,特異度は95.4%以上であることが示され,マイコプラズマの抗体価と PCR との間においても感度と特異度はそれぞれ90.2%と97.9%と優れていることが示されています 3)。
また,この方法では陽性反応を示すサイクル数から検体中に含まれる菌数も推定できることも示されています。つまり,マイコプラズマに関しては,私どもが公表しているプライマーとプローブを使用し,規定のサイクル数までの間に陽性反応がみられれば,マイコプラズマ感染症と診断してもほぼ差し支えないことになります。
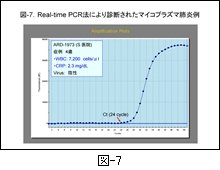
図-7 には,私どもの PCR 法でマイコプラズマ肺炎と診断された具体例を示します。症例は4歳の小児ですが,PCR の機器に接続されたパーソナルコンピューター画面で24サイクルから陽性反応が認められ,後日,菌の分離と抗体価の上昇が確認されています。
私どもでは,real-time PCR 法でマイコプラズマに陽性反応を示した検体については培養を実施し,同定確認の後に MLs に対する感受性試験と薬剤耐性に関わる遺伝子変異を調べています。
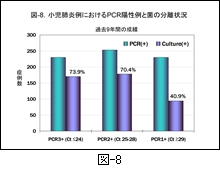
過去9年間にわたって real-time PCR 法でマイコプラズマが陽性であった症例と,それらの検体から実際にマイコプラズマが分離された割合を 図-8 に示します。24サイクルまでに陽性となった症例(Ct≦24)での培養陽性率は73.9%, 25-28サイクル(Ct25-28)の間での培養陽性率は70.4%,それ以上のサイクル数での陽性率は40.9%と劣り,当初の検体中に含まれるマイコプラズマの推定菌量がそのまま示される結果となっています。
8. MLs 耐性化のメカニズムと耐性レベル
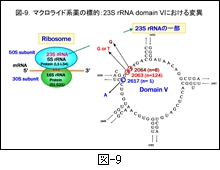
図-9 には,MLs に耐性化したマイコプラズマにみられる遺伝子変異を示します。MLs の作用標的はリボソームですが,薬剤は50S サブユニットを構成する 23 S rRNA のドメインVに結合し,ペプチジルトランスフェラーゼ活性を阻害します。その結果,タンパク合成が阻害され,菌はやがて死滅していきます。
しかし,MLs に耐性化したマイコプラズマでは,2063番目のアデニン(A) がグアニン(G)へ変異している株が多く認められ,次いでその隣の2064番目の A が G に変異している株も認められています。その他の変異株も多くはないのですが認められ始めています。これらの変異が生じると MLs がドメイン V に結合できなくなるため,酵素活性が阻害されずに菌は耐性化するのです。
図-10 には,最近3年間に分離したマイコプラズマの主だった MLs に対する感受性分布を示します。耐性菌は遺伝子の変異別に棒グラフの色を違えて示してあります。
MLs 耐性マイコプラズマは一部緑色で示した2063番目の A がチミン(T) に変異した株,あるいは紫色で示した2617番目のシトシン(C) が A に変異した菌で軽度耐性を示す株がありますが,その他の大部分の耐性菌はエリスロマイシン(EM), クラリスロマイシン(CAM) およびアジスロマイシ (AZM) に 32 μg/mL 以上の高度耐性を示しています。ここには示しませんでしたが,これら耐性菌はジョサマイシン(JM)やテリスロマイシン(TEL) にも 32μg/mL 以上の高度耐性を示します。
マイコプラズマは本来 MLs に対しては 0.01μg/mL 以下の優れた感受性を有していたのですが,遺伝子の1ヶ所の変異のために耐性化してしまっていることに,遺伝学上は大きな意味を持っています。
9. MLs 耐性菌感染症に使用できる他の抗菌薬は?
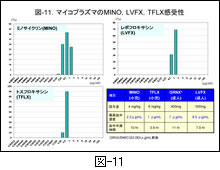
現在,MLs 以外の抗菌薬で小児のマイコプラズマ感染症への適応が認められているのはミノサイクリン (MINO) のみです。ニューキノロン系薬のトスフロキサシン (TFLX) が最近小児の肺炎に対する適応を認められていますが,対象菌種にマイコプラズマは入っておりません。
本邦では成人のマイコプラズマ肺炎における耐性菌の出現状況は調べられていませんのでそのことには触れませんが,耐性菌による感染症例が既に報告されています 14)。最近 TFLX と同系列にあるレボフロキサシン (LVFX) が成人のマイコプラズマ疾患に対しての適応拡大を取得しています。しかし,LVFX の小児に対する安全性は確認されておりません。その他にガレノキサシン (GRNX) も成人マイコプラズマの適応があります。
図-11 に,上記3薬剤のマイコプラズマに対する感受性分布を示します。確かに3薬剤とも現状では耐性菌は認められていません。しかし,その MIC は 0.5~1.0μg/mL を中心とする薬剤濃度に集中しており,マイコプラズマに本来感性であった MLs の MIC に比しては,はるかに劣っています。
ただし,菌に対する効果は MIC のみならず,投与された際の体内濃度(正確には肺内濃度)とも関係を有しますので,それぞれの通常の経口投与量,最高血中濃度,およびその半減時間を参考までに 図-11の右下 に示しました。経口薬ですからヒトによっては薬剤の吸収性にバラつきが生じ,場合によっては MIC が最高血中濃度とほぼ同じレベルにあると考えられる菌が存在する可能性のあることにも留意すべきです。
その他のレスピラトリーキノロン薬に対する感受性はほとんど測定していないので詳細は不明ですが,マイコプラズマに優れた感受性を示し,かつ安全性の高い薬剤を早急に探すべきと思います。
10. MLs 耐性マイコプラズマによる肺炎例の臨床経過
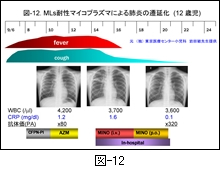
図-12 に MLs 耐性マイコプラズマによる肺炎の1例を参考までに示します。この症例は12歳の女児で,(独)国立病院機構 東京医療センターで経験された症例です。現慶應義塾大学医学部感染制御センター教授の岩田敏先生の提供によるものです。
マイコプラズマ感染症と診断され MLs が投与されたにも関わらず,臨床症状が改善しないことと胸部レ線像の増悪がみられたことから,耐性菌を疑い入院加療となっています。入院時に実施された上咽頭ぬぐい液の real-time PCR 検索でマイコプラズマ陽性と判定され,後日培養によって菌が分離され,耐性菌であることが判明しています。
入院後に MINO の静注(2日間)に変更され,24時間後には解熱しています。その後は MINO の経口投与(2日間)に切り替え,5日後に退院となっています。
11. MINO 使用後の菌の消長
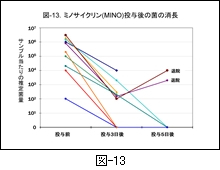
図-13 には,小児のマイコプラズマ肺炎例で遷延化して入院を余儀なくされ,MINO が投与された10症例の菌の消長を示します。検査材料には上咽頭ぬぐい液を使用し,real-time PCR 法と培養により確かめています(未発表データ)。
臨床的には MINO の投与開始後,ほとんどの症例が24時間以内に解熱し,咳嗽を含む臨床症状と胸部所見の改善が認められました。
しかし,マイコプラズマそのものは,MINO 投与開始後3日目に3例は陰性化していましたが,残りの7例では推定菌量は減少しているとはいえ残存しています。この現象には経口薬としての吸収性のバラツキが反映されているのかも知れません。また,MINO そのもののマイコプラズマに対する抗菌作用が殺菌的であるのか,静菌的であるかということとも関係しているのかも知れません。いずれにしても今後の研究課題です。
しかしながら,MINO 投与後3日目で菌量が減少するに留まった症例においても,解熱と臨床症状も改善しており,再発・再燃例も見られていないことです。マイコプラズマ感染症においては,病巣内の菌量を1/100あるいは1/1,000以下に減少することができれば,治療そのものに支障がないのかもしれません。これも今後の研究課題と思います。
その反面,今までに集計された症例の中には臨床症状が強く,また重症化例では,抗菌薬と同時にステロイドが使用された例が15%程度あります。特に発症から1週間以上の遷延化例でステロイドが投与された例においては,各種炎症性マーカーの値が亢進している例がみられ,ことに LDH やフェリチンなどの値が上昇している例が目立つ傾向にあります。ステロイド投与のタイミングと,いかなる時に投与すべきかという臨床検査値との関連については,今後明確にする必要があるように思います。
12. まとめ
本年大流行している MLs 耐性マイコプラズマについて基礎から臨床まで述べました。
そもそもマイコプラズマ感染症は4年ごとに繰り返されるといわれていましたが,それも 図-1 をみますと崩れつつあります。流行は学童から始まり,学童によって家族内へ持ち込まれ,さらに家族内感染へと広まっていくようです。
マイコプラズマ感染症は本菌独特の増殖様式から,遷延化すればするほど各種炎症性サイトカインもまた誘導され,間接的な炎症反応が強くなることが考えられます。クラリスロマイシン等が炎症反応に関わるサイトカインの産生を抑制する作用があることから,耐性菌の治療においても効果が期待できるとする報告 15)もあります。しかし,MLs耐性マイコプラズマの現状と臨床症状が遷延化する症例の明らかな増加傾向からは,このまま見過ごしているわけにはいかないことも事実です。
現状の対策としては,当研究に参加していただいている小児科の先生方のご意見によれば,「遷延化している症例には結局のところMINOを使用するしかないが,その使用期間は臨床効果が得られる最小期間にすべきで,その指標となる臨床所見の集積がこれからの最も緊急を要する研究課題である」とのことです。MINOの添付文書によれば「歯牙形成期にある8歳未満の小児に対する使用は,予測される副作用を上まわる効果が期待できる場合のみ」と記載されています。そのほかにも留意すべき副作用も記載されています。
今までの成績からは,「マイコプラズマの上咽頭における菌の消長と臨床症状の改善状況から考える限り,MINOの使用期間は通常3日,長くても5日以内とし,その後は自然治癒力に期待するのが賢明である」というのが,本研究に参加いただいている小児科の先生方の大方のご意見であることを付記しておきます。
謝辞
当研究にご参加いただいておられる在京の先生方の多くは,マイコプラズマ感染症に限らず,小児呼吸器感染症の検体を自らが採取して持参され,当研究室でご自身の手で real-time PCR 法を実施しておられます。その姿勢には心打たれるものがあります。このような研究は基礎と臨床とが共同して行なわない限り,決して遂行できるものではありません。先生方各位,ならびに先生方から受け継ぐ基礎的研究を精力的にこなしている当研究室の研究員に心より感謝を申し上げる次第です。
現在,この研究に携わっておられる先生方は下記の方々であることを申し添えます。
| 岡田 隆文,松原 啓太 | (独)国立病院機構 東京医療センター 小児科 |
|---|---|
| 長谷川 真紀 | 日本大学医学部付属練馬光が丘病院 小児科 |
| 中山 栄一,田島 剛 | (財)博慈会記念総合病院小児科 |
| 坂田 宏 | JA北海道厚生連旭川厚生病院 小児科 |
| 大成 滋 | なかふかわ小児科 |
| 武井智昭 | 平塚共済病院 小児科 |
| 岩田 敏 | 慶應義塾大学医学部感染制御センター (元(独)国立病院機構 東京医療センター) |
(敬称略)
引用文献
- Suzuki S, Yamazaki T, Narita M, et al.: Clinical evaluation of macrolide-resistant Mycoplasma pneumoniae. Antimicrob Agents Chemother 50:709-712, 2006
- Matsubara K, Morozumi M, Okada T, et al.: A comparative clinical study of macrolide-sensitive and macrolide-resistant Mycoplasma pneumoniae infections in pediatric patients. J Infect Chemother 15:380-383, 2009
- Morozumi M, Nakayama E, Iwata S, et al.: Simultaneous detection of pathogens in clinical samples from patients with community-acquired pneumonia by real-time PCR with pathogen-specific molecular beacon probes. J Clin Microbiol 33:1440-1446, 2006
- Hamano-Hasegawa K, Morozumi M, Nakayama E, et al.: Comprehensive detection of causative pathogens using rea-time PCR to diagnose pediatric community-acquired pneumonia. J Infect Chemother 14:424-432, 2008
- Okazaki N, Narita M, Yamada S, et al.: Characteristics of macrolide-resistant Mycoplasma pneumoniae strains isolated from patients and induced with erythromycin in vitro. Microbiol Immunol 45:617-620, 2001
- Morozumi M, Hasegawa K, Kobayashi R, et al.: Emargence of macrolides-resistant Mycoplasma pneumoniae with a 23S rRNA gene mutation. Antimicrob Agents Chemother 49: 2302-2306, 2005
- Morozumi M, Iwata S, Hasegawa K, et al.: Increased macrolide resistance of Mycoplasma pneumoniae in pediatric patients with community-acquired pneumonia. Antimicrob Agents Chemother 52: 348-350, 2008
- 佐々木裕子:マイコプラズマのゲノム解析.臨床と微生物 30:009-013, 2003
- Himmelreich R, Hilbert H, Plagens H, et al.: Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae. Nucleic Acids Res 24:4420-4449, 1996
- Montague MG, Fedorova NB, Durkin AS, et al.: Mycoplasma pneumoniae FH complete genome (Accession number: CP002077.1), 2010
- Nakane D, Adan-Kubo J, Kenri T, et al.: Isolation and characterization of P1 adhesin, a leg protein of the gliding bacterium Mycoplasma pneumoniae. J Bacteriol 193:715-722, 2011
- 金光敬二,賀来満夫: マイコプラズマ感染症の診断.臨床と微生物 30:041-046, 2003
- Saito R, Misawa Y, Moriya K, et al.:Development and evaluation of a loop-mediated isothermal amplification assay for rapid detection of Mycoplasma pneumoniae. J Med Micriobiol 54:1037-1041, 2005
- Isozumi R, Yoshimine H, Morozumi M, et al.: Adult case of community-acquired pneumonia caused by macrolide-resistant Mycoplasma pneumoniae. Respirology 14:1206-1208, 2009
- 成田光生:薬剤耐性マイコプラズマの現状と今後の展望. モダンメディア 53: 297-306, 2007