9. ゲノム解析
この項で述べた β 溶血性レンサ球菌のうち,S. pyogenes (GAS) と S. agalactiae (GBS) の病原因子については既に多くの先駆者によって膨大な研究がなされています。
また,遺伝子解析が容易に行なえるようになった現在,肺炎球菌,GAS,GBS については各々かなりの菌株数の全ゲノム解析が終了し,その遺伝子情報が公開されています。
S. dysgalactiae subsp.equisimilis (SDSE) については,ゲノム解析情報はありませんでした。
下村および秋山ら(国立国際医療センター研究所,感染症制御研究部) はその点に着目し,劇症型由来のSDSE株(STSS 例由来,菌株番号: GGS_124,emm 型:stG480)について全ゲノム解析を行い,その情報を公開 (GeneBank Accession No.: AP010935) すると同時に論文として発表しました (BMC Genomics 12:17-,2011)。その後,村山,秋山,および岡田 (大学院生) らは,わが国で最も分離頻度の高いタイプの SDSE 株 (STSS例由来,菌株番号:RE378,emm 型:stG6792.3)と,リンパ節炎を起こしたブタ由来の SDSE 株 (リンパ節炎由来,菌株番号:L1株 ,emm 型:stL2764 (酪農学園大学 菊池先生,高橋先生より分与を受ける) について全ゲノム解析を行なっています (未発表データ)。
ここではそれらのデータの中から,レンサ球菌感染症を理解する上で知っておきたい病原性に関する情報を記述します。
1) 全ゲノム解析からみた SDSE と他のレンサ球菌との関係
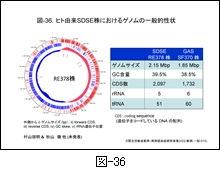
図-36 には村山および秋山らが解析した RE378株の環状ゲノム図を示します。外側から i) ゲノムサイズ,ii) forward CDS(coding sequence,遺伝子をコードしている DNA 配列), iii) reverse CDS, iv) GC skew(一本鎖DNA分子におけるG含量とC含量のバイアスを表す指標で,(C-G)/(C+G)の式で表すもの),および v) 5ヶ所の rRNA 遺伝子位置が示してあります。 ゲノムサイズは GAS に比してやや大きく2.15 Mbp,GC 含量は39.5%です。
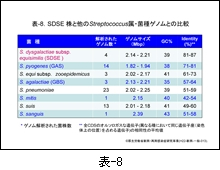
その後解析された株も含めた SDSE の4株とその他のレンサ球菌のゲノムサイズ,GC含量,および全 CDS のオルソロ-ガス遺伝子 (異なる種において同じ遺伝子座(染色体上の位置)を占める遺伝子) の相同性を比較した成績は 表-8 に示します。レンサ球菌のゲノムサイズは通常2 Mbp以上ですが,GAS はやや小さいことが判ります。GC含量は GBS が35.6%と最も低く,次いで GAS,肺炎球菌の順で,次が SDSE となっています。
問題は,SDSE とその他の菌種との相同性ですが,オルソロ-ガス遺伝子の相同性は GAS とのそれは71-81%と高いのに対し,GBS とは57-64%,肺炎球菌とはわずかに50-60%です。
この相同性を判りやすいようにゲノム再配置マップとして 図-37 に示します。赤は遺伝子の相同性が90%以上と高い場合,ピンクは70%,グリーンは40%,ブルーは20%を表しています。
SDSE と GAS,GBS,あるいは肺炎球菌,SDSE 同士のそれぞれを比較しますと,SDSE は GAS 遺伝子と相同性の高い遺伝子をいかに多く保持しているかが判ります。つまり病原遺伝子も共通するものが多いのであろうということが推測できるわけです。
SDSE と GBS では,全般的に相同性の高い遺伝子は非常に少ないのですが,1ヶ所集中して相同性の高い部分があります。このような領域は SDSE から GBS へ遺伝子が水平伝播したのかあるいはその逆に GBS から SDSE へ伝播したのかは定かではありませんが,いずれにしても両菌種間において過去に遺伝子組換えが生じていたことが示唆されるのです。
SDSE と肺炎球菌の比較では,多少相同性の高い遺伝子の存在も認められますが,遺伝学的にみますと相同性は明らかに低いことが示されています。
SDSE 株同士では当然のことながら高い相同性を認めますが,それでも遺伝子配列の異なる部分が5ヶ所ほど認められます。
2) GAS と SDSE にみいだされる主な病原遺伝子の比較
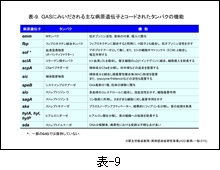
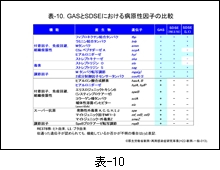
先ず,GAS の主な病原性遺伝子とそれにコードされたタンパク,およびその機能を 表-9 に示し,それらの遺伝子が SDSE にも存在するのか否かを 表-10 に示します。
菌の病原性因子は,i) 宿主細胞への付着と侵入に関わるもの,ii) 宿主免疫系からの回避に関わるもの,iii) そして侵入後における組織への拡散や傷害作用に関わるものと,大きく3つに分けることができます。
i) に区分される M タンパクは ii) の機能も有していることは M タンパクの図で説明したとおりです。その他にフィブロネクチン結合タンパク(fbp),オパシティーファクター(sof ), コラーゲン様タンパク(sclA)などがあります。 ii) には,M タンパクやフィブロネクチン結合タンパクの他に,補体成分 C5a を不活化するペプチダーゼ(scpA),補体の膜傷害性複合体(MAC)形成インヒビター(sic)などがあります。
一方,iii) には組織間への菌の拡散を助長するストレプトキナーゼ(ska)やヒアルロニダーゼ(hylA, hylP, hyl),組織壊死に関わるとされるストレプトリジンO(slo)やストレプトリジンS(sag),システインプロテアーゼ(speB)などがあります。
表-10 をみますと,SDSEは菌の付着や侵入に関わる産物,あるいは侵入後の菌の拡散に関わる産物,その転写調節に関わる遺伝子の mga(g) や covR/S など多くを保持していますが,表の下方に示す speB,sic,speG 等は完全な遺伝子としては保持していないようです。
いずれにしても,この成績から SDSE が GAS の保有する多くの病原性因子を保持し,同様の疾患を起こすことが理解できると思います。
3) 病原性に関わる遺伝子からの産物の制御
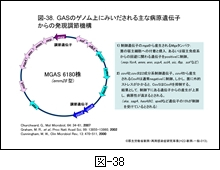
GAS における病原性発揮に関わる主な遺伝子のゲノム上の位置を 図-38 に示します。同図に示す SDSE にもみいだされる多くの産物は,発現調節遺伝子である mga 遺伝子(multiple gene activator)の正の制御,あるいは covR/covS の2成分系発現調節遺伝子の制御を受けています。
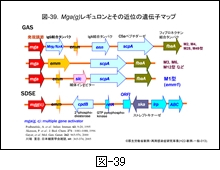
図-39にはGAS と SDSE における mga 遺伝子による調節領域部分を比較しながら示します。GAS では,IgG 結合タンパク mrp/fcrA 遺伝子,Mタンパクの emm 遺伝子,IgA 結合タンパクの enn 遺伝子,C5a ペプチダーゼの scpA 遺伝子,補体インヒビターの sic 遺伝子などが調節されています。mga 遺伝子に支配される Mga タンパクの産生は,菌の対数増殖後期や培養時の炭酸ガス濃度の上昇(O2濃度の低下かも知れない)で高まりますが,その下流域に存在する遺伝子群のそれぞれのプロモーター領域部分に結合すると,それらの転写活性が一挙に高まります。やや離れた位置にある遺伝子(sclA,sof : 図38参照)でも転写活性が高まっていることが証明されています。
近年明らかにされたのは covS/covR 遺伝子による2成分系発現調節機構です。covR にコードされたCovRはストレプトキナーゼ(ska),ストレプトリジン(sagA),システインプロテアーゼ(erythrogenic toxin B : speB),ヒアルロン酸合成酵素(hasA,B)を制御しているとされます。これらは通常 CovR によって産生が抑制(負の制御)されていますが,菌に外的ストレスがかかると CovS が CovR を抑制するため,各遺伝子に対する抑制が解除され,それぞれの産生が高まります。つまり,結果的には病原性が高まることになります(図-38も参照)。
4) 線溶系の活性化
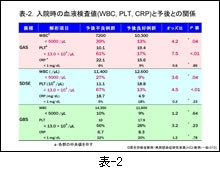
GAS および SDSE の感染による「予後不良例」では,血液検査値の PLT 値が有意に低値を示すことを述べました(β溶血性レンサ球菌の項,表-2参照)。
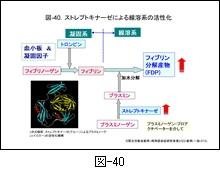
この現象には菌が産生するストレプトキナーゼによる線溶系の活性化が大きく影響していると考えられます。 図-40 に示すように,ストレプトキナーゼはプラスミノーゲンをプラスミンに変換しますが,産生量が著しく増加したプラスミンは次々とフィブリンを加水分解し,フィブリン分解産物(FDP)を増大させます。つまり,線溶系が活性化されるため,血小板の著しい消費が起こっていると推定されます。酸素濃度の低い条件下でストレプトキナーゼ産生能が高まる菌によって,病態が進行した際のひとつの特徴ではないかと考えます。
『しかし,GAS,SDSE,そして GBS によってヒトに侵襲性感染症が惹起された場合には,病原性は i) さまざまな菌側の因子,および ii) 宿主側のリスクファクターによって左右されることを常に念頭におく必要があります』
5) ゲノム解析からみえるレンサ球菌の進化
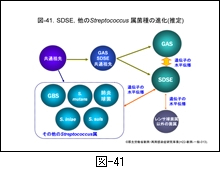
この項では病原性に乏しいとされてきた SDSE が,なぜ GAS と同じような疾患を引き起こすのか,ゲノム解析からみえる成績を中心に記しましたが,そのまとめとして,現在の GAS あるいは SDSE の進化を推定図として 図-41 に示しました。
はるか遠い昔,レンサ球菌は共通の祖先から出発し,環境(宿主がヒトかあるいは動物か等)に適応しながら進化してきたと想像されます。その過程において,GAS と SDSE は長い間祖先は共通であったと推定されます。しかし,進化の過程で恐らく 図-42 に示す染色体上の溶原化ファージから何らかの刺激でファージ粒子が形成されるとき,染色体 DNA もファージ粒子内に取り込まれ,他のレンサ球菌へと水平伝播したと推定されるのです。伝達された DNA は,新たな菌の中でさらに DNA の欠失や組換えが生じています。
ファージによる遺伝子伝達は,肺炎球菌や黄色ブドウ球菌などのグラム陽性球菌では古くから知られたことですが,このようにしてこれからも多くの細菌は進化していくことでしょう。
6) まとめ
この10年来,わが国でのレンサ球菌に関する研究は,少数の研究者によって続けられてきましたが,欧米では本菌による感染症に常に高い関心が払われています。
例えば,CDC では肺炎球菌,GAS,GBS,インフルエンザ菌,髄膜炎菌,リステリア菌の6菌種について,Active Bacterial Core Surveillance によって1997年から大規模疫学研究が継続して行なわれているのです。そのような基礎研究から,肺炎球菌ワクチン同様に GBS の莢膜に対するワクチンが開発され,南アフリカで既に治験が開始されています。
翻って,わが国の急速な少子高齢化社会に伴う市中型重症感染症に対応するためには,予防に重点をおいた施策が必要であろうと結論されます。
謝 辞
ヒト由来 SDSE の RE378 株に関する膨大なゲノム解析は,研究協力者の村山琮明先生(現 日本大学薬学部 分子細胞生物研究室 准教授)を中心に行なわれました。
また,ブタ由来 L1 株のゲノム解析は,村山琮明先生ならびに岡田圭祐君(北里大学感染制御科学府修士課程 大学院生)によって行なわれました。
誠意をもって熱心に行なわれた研究に対し,心より感謝申し上げます。